醫(yī)療器械產(chǎn)品技術要求編號:XXXXXXXXX
一次性使用無菌導尿管
1.產(chǎn)品型號/規(guī)格及其劃分說明
1.1組成結構
一次性使用無菌導尿管(以下簡稱:導尿管)分為單腔、兩腔和三腔�����。結構見圖1-圖3�。
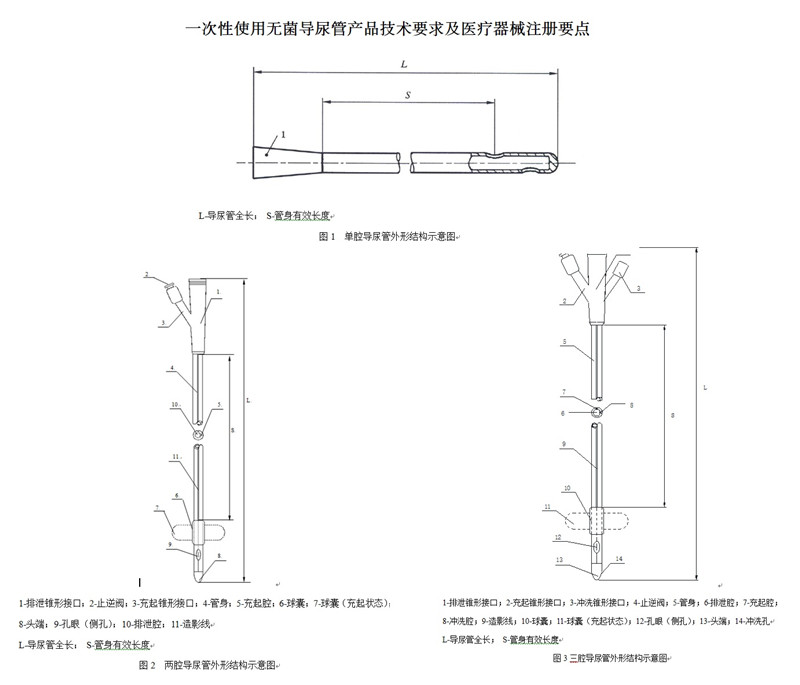
1.2型號規(guī)格
導尿管的型號規(guī)格見表1�����。
表1導尿管型號規(guī)格表
型號 | 規(guī)格 | 公稱外徑(Φ)/mm ±0.33 | 導尿管 標稱全長(L)/mm ±50 | 有效長度(S)/mm | 球囊容積 /ml |
|
|
|
|
|
|
 1.3材料
1.3材料
導尿管的部件所用的材料見表2���。
表2導尿管構成部件材料表
2.性能指標
2.1外觀
管身、尖部�����、球囊和孔眼應無外來物質���,且不應有加工缺陷和表面缺陷����。
2.2尺寸
導尿管應用其公稱外徑(mm)表示其規(guī)格�,精確到0.1mm。其公差應為±0.33mm���。球囊容積應以毫升(ml)表示���。
球囊導尿管的管身外徑、全長�����、有效長度�����、球囊容積應符合表1的規(guī)定�。
2.3強度
當按YY 0325-2016附錄A所給方法試驗時,尖部和錐形接口應與管身連為一體����,管身應無斷裂。
2.4連接器分離力
當按YY 0325-2016附錄B所給方法試驗時�����,排泄錐形接口應不與試驗連接器分離����。
2.5球囊可靠性
2.5.1當按YY 0325-2016附錄C所給方法試驗時,球囊應無泄露����,并且不應影響排泄孔。
2.5.2當按YY 0325-2016附錄D所給方法試驗時����,水的回收率應不低于表3的規(guī)定值����。
表3球囊試驗回收百分率
公稱球囊容積 ml | 試驗體積回收最小百分比 % |
3 5 10 15 20 30及以上 | 50 55 75 75 80 80 |
2.6耐彎曲性
按YY 0325-2016附錄E試驗時���,彎曲導尿管各腔的液體流量應不低于平直導尿管液體流量的50%���。
2.7流量
向球囊中充入公稱容積的蒸餾水,按GB/T 15812.1-2005中附錄E所給方法試驗時�,流量應符合表4規(guī)定。
表4平均流量
標稱規(guī)格 | 平均流量(最小值) |
外徑(mm) | 規(guī)格(Fr) | 排泄腔(mL/min) | 沖洗腔(mL/min) |
2.0 | 6Fr | 10 | 不適用 |
2.7 | 8Fr | 15 | 不適用 |
3.3 | 10Fr | 30 | 不適用 |
4.0 | 12Fr | 50 | 不適用 |
4.7 | 14Fr | 70 | 25 |
5.3 | 16Fr | 100 | 25 |
6.0 | 18Fr | 100 | 25 |
6.7 | 20Fr | 100 | 25 |
7.3 | 22Fr | 100 | 30 |
8.0 | 24Fr | 100 | 30 |
8.7 | 26Fr | 100 | 30 |
9.3 | 28Fr | 100 | 不適用 |
10.0 | 30Fr | 100 | 不適用 |
2.8無菌
產(chǎn)品應無菌���。
2.9耐腐蝕性(如適用)
如有金屬部件���,按GB/T 15812.1-2005中附錄A進行試驗時,試樣應無腐蝕跡象����。
2.10 化學性能
2.10.1環(huán)氧乙烷殘留量(如適用)
環(huán)氧乙烷殘留量應不大于10μg/g。
2.10.2酸堿度
檢驗液與同批空白對照液相比����,pH值之差不得超過2.0���。
2.10.3重金屬含量
檢驗液重金屬總含量不超過5μg/ml。
2.10.4還原物質
檢驗液與空白液消耗濃度為0.002mol/L高猛酸鉀溶液的體積之差應不超過2.0ml����。
2.10.5蒸發(fā)殘渣
蒸發(fā)殘渣總量不超過2.0mg����。
2.11涂層表面滑動性能(如適用)
按YY/T 1536-2017所給方法試驗,滑動性能的試驗力值應符合制造商的規(guī)定��。
3.檢驗方法
3.1外觀
手感�,目測,結果應符合2.1的要求��。
3.2尺寸
用通用或專用量具測量���,結果應符合2.2的要求�。
3.3強度
按YY 0325-2016附錄A所給方法進行試驗�,結果應符合2.3的要求。
3.4連接器分離力
按YY 0325-2016附錄B所給方法進行試驗����,結果應符合2.4的要求�。
3.5球囊可靠性
3.5.1按YY 0325-2016附錄C所給方法進行試驗����,結果應符合2.5.1的要求。
3.5.2按YY 0325-2016附錄D所給方法進行試驗���,結果應符合2.5.2的要求���。
3.6耐彎曲性
按YY 0325-2016附錄E的方法進行試驗,結果應符合2.6的要求�。
3.7流量
按GB/T 15812.1-2005中附錄E所給方法進行試驗,結果應符合2.7的要求����。
3.8無菌
按中華人民共和國藥典(2020年版四部)的方法進行檢驗,結果應符合2.8的規(guī)定�。
3.9耐腐蝕性試驗(如適用)
按GB/T 15812.1-2005中附錄A的方法進行試驗,結果應符合2.9的要求��。
3.10化學性能
3.10.1環(huán)氧乙烷殘留量(如適用)
按GB/T 14233.1-2008中規(guī)定的方法進行測試����,結果應符合2.10.1的要求。
3.10.2酸堿度試驗
取檢驗液,按GB/T 14233.1-2008中5.4.1規(guī)定的方法進行�,結果應符合2.10.2的要求。
3.10.3重金屬總含量試驗
取檢驗液�,按GB/T 14233.1-2008中5.6.1規(guī)定的方法進行,結果應符合2.10.3的要求�����。
3.10.4還原性物質試驗
取檢驗液�,按GB/T 14233.1-2008中5.2.2規(guī)定的方法進行,結果應符合2.10.4的要求�����。
3.10.5蒸發(fā)殘渣試驗
取檢驗液��,按GB/T 14233.1-2008中5.5規(guī)定的方法進行���,結果應符合2.10.5的要求。
3.11 涂層表面滑動性能(如適用)
按YY/T 1536-2017所給方法試驗��,應符合2.11的要求�����。
如有一次性使用無菌導尿管產(chǎn)品技術要求及醫(yī)療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡��,聯(lián)系人:呂工�,電話:18058734169,微信同�����。